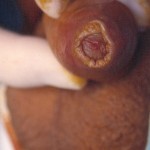
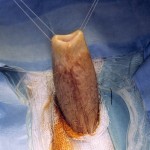
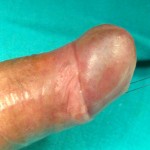
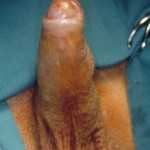
Il termine Ipospadia Fallita si riferisce ai pazienti (per la maggior parte adulti) che, dopo aver subito in passato 1 o più interventi per la riparazione di ipospadia, presentano complicanze uretrali e peniene.
La riparazione dell’ipospadia vergine (primaria) viene effettuata solitamente in età pediatrica. Spesso, purtroppo l’intervento viene descritto da parte del chirurgo come una banale circoncisione. In realtà si tratta di un intervento che nel 30% circa dei casi può esitare in complicanze.
Le complicanze sono dovute al fatto che l’ipospadia è caratterizzata da una carenza di sviluppo di tessuti sulla faccia ventrale del pene e, quindi, è impossibile creare un canale uretrale che abbia le stesse caratteristiche strutturali dell’uretra normale. In realtà viene costruito un canale uretrale che presenta una parete sottile e sclerotica. Durante la pubertà, il pene si sviluppa, ma la neo-uretra probabilmente non segue il pene nel suo sviluppo.
Spesso, questi pazienti hanno subìto più interventi e presentano diverse complicanze.
I genitori dei bambini sottoposti a chirurgia riparativa dell’ipospadia in età infantile o adolescenziale dovrebbero essere informati sulla necessità di continuare i controlli anche in età adulta, in quanto esiste la possibilità non rara che si sviluppino delle complicanze uretrali e peniene.
Questi pazienti plurioperati possono presentare i seguenti problemi :
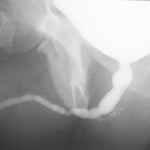
- Ipospadia residua: l’anomala posizione del meato impedisce di urinare in piedi [Fig 103]
- Stenosi uretrale: meato o uretra ristretta con impedimento ad urinare ed infezioni urinarie ricorrenti.
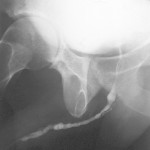
- Fistola uretrale da cui fuoriesce l’urina [Fig 104]
- Calcoli uretrali [Fig 105]
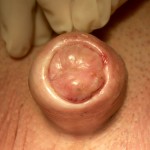
- Peli nell’uretra con infezioni urinarie ricorrenti [Fig 106].-Presenza di una malattia dermatologica associata (Lichen Sclerosus:) che compromette ulteriormente il pene e l’uretra [FIGURE 101 – 102]
Problema sessuale
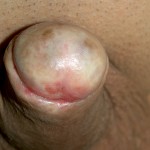
- Curvatura del pene (a causa delle cicatrici post-operatorie o di un associato asimmetrico sviluppo dei corpi cavernosi) che ostacola la penetrazione in vagina [FIGURE 107]
- l’anomala posizione del meato (o un’ampia fistola uretrale) impedisce una corretta eiaculazione in vagina e la capacità di fecondare la donna [Fig 103]
- una stenosi uretrale può determinare un’eiaculazione dolorosa ed ostacolare l’eiaculazione in vagina con la conseguente riduzione della capacità di fecondazione
- erezione dolorosa esito di cicatrici post-operatorie retraenti
Problema estetico l’anomalo aspetto estetico del pene (meato anomalo, fistole, cicatrici, pene curvo) del pene causa importanti ripercussioni psicologiche [Fig. 107, 115, 116, 117, 118].
Problema socio-psico-sessuale Le problematiche urinarie, sessuali ed estetiche possono ripercuotersi sulla vita sociale di relazione ed avere un impatto psicologico importante
Come si fa la diagnosi
Gli esami diagnostici fondamentali sono:
Uroflussometria : il paziente urina in un contenitore collegato ad un computer. Vengono registrati i valori del flusso urinario: la riduzione della forza del flusso (flusso massimo < 14 ml/sec.) può indicare un ostacolo alla minzione.
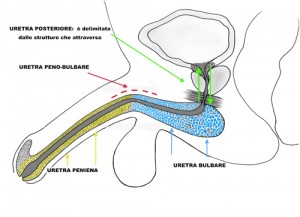
Uretrografia : esame radiologico con mezzo di contrasto che visualizza l’uretra e la vescica. In presenza di una storia di allergia ai mezzi di contrasto il paziente deve avvisare il medico. L’esame è fastidioso e deve essere effettuato da persone particolarmente esperte e che lavorano di routine in questo campo. E’ l’esame più importante per la diagnosi di stenosi e fondamentale per pianificare l’intervento chirurgico di riparazione dell’uretra.L’esame si divide in due momenti:1.- Uretrografia retrograda : il mezzo di contrasto viene iniettato nell’uretra attraverso uno strumento particolare (una cannula collegato ad un imbuto piccolo da appoggiare delicatamente al meato uretrale : FIGURE 108, 109, 110, 111, 112). Viene visualizzata tutta l’uretra anteriore (uretra peniena e uretra bulbare).
| Fig-108 | Fig-109 |
 |
 |
| Fig-110 | Fig-111 |
 |
 |
| Fig-112 | |
 |
Fig-X4

2.- Uretrografia minzionale [Fig X 4]: la vescica viene riempita con il mezzo di contrasto introdotto nell’uretra per via retrograda. Non appena il paziente avrà la sensazione di massimo riempimento della vescica, lo strumento che inietta il mezzo di contrasto viene rimosso e vengono effettuate delle radiografie mentre il paziente urina. L’esame studia tutta l’uretra, compresa la parte posteriore (uretra prostatica), e visualizza la stenosi ed il suo grado di importanza durante la fase della minzione.
Uretroscopia: introduzione dal meato di un uretroscopio per studiare le condizioni interne delle pareti dell’uretra ed avere tutte le informazioni utili ai fini della scelta dell’intervento chirurgico. L’esame viene effettuato con estrema delicatezza e con uno strumento molto sottile per non danneggiare l’uretra. Allo scopo di una valutazione utile per il medico e priva di sofferenza per il paziente, l’esame va effettuato in anestesia.
Altri esami supplementari sono:
| Fig X – 5 | |
|
Ecografia dell’uretra: per ridurre il fastidio viene effettuata contemporaneamente all’uretrografia retrograda. Dà informazioni aggiuntive: esatta lunghezza dei tessuti uretrali malati coinvolti nella stenosi [ Fig X 5].
Urinocoltura: la stenosi uretrale può causare incompleto svuotamento della vescica durante la minzione con conseguente ristagno di urina, infezione e urinocoltura positiva (presenza di germi nelle urine). |
 |
Perché operare?
L’intervento chirurgico mira a ripristinare la funzione urinaria:
- riparare l’uretra ristretta, rimuovere i calcoli e i peli nell’uretra, riparare le fistole
- portare il meato uretrale in cima al pene
- ripristinare la funzione sessuale e l’aspetto estetico dei genitali: ricostruire un’uretra ed un meato uretrale che consentano il corretto passaggio dello sperma
- correggere la curvatura del pene
- rimuovere le cicatrici deformanti
- creare un aspetto estetico del pene simile alla normalità, con la completa ricostruzione estetica del pene-glande-meato
- ritrovare l’equilibrio socio-psico-sessuale:L’intervento chirurgico tende a migliorare i problemi psicologici e relazionali del paziente perché vuole dare una risposta a tutti e 3 i problemi (urinari, sessuali, estetici) consentendo di: risolvere i disturbi legati all’ostacolata emissione di urina e sperma e le infezioni urinarie ricorrenti
- urinare in piedi senza bagnarsi
- avere una buona attività sessuale
- avere un aspetto estetico del pene soddisfacente.
Tecniche chirurgiche
Esistono differenti tecniche chirurgiche che prevedono l’impiego della cute del prepuzio o della mucosa buccale per ricostruire l’uretra.
La scelta del tipo di intervento dipende dalle condizioni dei tessuti uretrali/penieni e dalla storia del paziente (età, storia clinica, condizioni generali).
Le tecniche chirurgiche più utilizzate sono:
Uretroplastica in tempo unico di Asopa (l’uretra viene riparata con un solo intervento): l’uretra viene incisa ed ampliata con un innesto di prepuzio o mucosa buccale. [ FIGURE 113]
| Fig-113 |
|
|
Uretroplastica in due tempi di Bracka [ FIGURE Bracka 2 tempi: 114]: l’uretra viene ricostruita con 2 interventi effettuati a distanza di più di 6 mesi uno dall’altro.
Primo tempo chirurgico : il pene viene aperto ventralmente e l’uretra malata viene rimossa e sostituita con una “mattonella” di mucosa buccale. Per alcuni mesi il paziente urinerà da un meato situato lungo la faccia ventrale del pene.
Secondo tempo chirurgico : dopo alcuni mesi la “mattonella” di mucosa buccale viene trasformata in tubo ed il meato uretrale ritorna all’apice del glande.
Un catetere piccolo e morbido devia le urine per circa 10 giorni.
Bisogna sottolineare il fatto che spesso possono essere necessari più di due interventi per la riparazione dell’uretra.
Le tecniche chirurgiche impiegate nella riparazione dell’ipospadia complicata devono mirare oltre alla riparazione dell’uretra anche ad una soddisfacente ricostruzione estetica del pene, del glande e del meato uretrale.
Nel Capitolo allegato sono descritte nel dettaglio le tecniche chirurgiche ricostruttive impiegate nella ricostruzione dell’uretra peniena. Questo Capitolo fa parte dell’Atlante di Chirururgia Peniena Ricostruttiva (Atlas of peniel reconstructive surgery. Pacini Editore S.p.a.)
Mucosa buccale
E’ attualmente il tessuto di prima scelta da impiegare nella chirurgia uretrale.
Il nostro Centro è stato il primo in Italia ed uno dei primi in Europa ad utilizzare la MB nella ricostruzione dell’uretra.
La MB ha rivoluzionato questa chirurgia perché si è rivelata un tessuto particolarmente resistente e adatto a sostituire l’uretra.
L’impiego della mucosa buccale ha sostituito l’impiego della cute del pene che non sempre è ben accettato perché richiede la circoncisione. Inoltre i pazienti già sottoposti a riparazione di ipospadia spesso presentano un carenza di tessuti cutanei penieni che rende imperativo il ricorso alla MB.
Il prelievo (un esagono di 1.5 x 5 cm) [ Fig MB 1-2-3-4-5-6 ] viene effettuato dalla guancia interna e la ferita viene suturata: il fastidio in bocca dura solo pochi giorni, il paziente può riprendere a mangiare il giorno dopo l’intervento e i punti di sutura si riassorbono spontaneamente dopo circa 1 mese.
Abbiamo effettuato dal 1995 più di 200 prelievi di mucosa buccale: non si è verificata nessuna complicanza e tutti i pazienti dichiarano che in caso di necessità rifarebbero il prelievo di mucosa buccale. E’ sconsigliabile effettuare il prelievo dal labbro perché c’è il rischio di complicanze: difficoltà ad aprire la bocca, alterazione dell’espressione del viso.
| Fig-MB1 | Fig-MB2 |
 |
 |
| Fig-MB3 | Fig-MB4 |
 |
 |
| Fig-MB5 | Fig-MB6 |
 |
 |
Altri tessuti di sostituzione uretrale
Cute del pene
Sino a 10 anni fa è stato il tessuto di sostituzione uretrale più impiegato. Il suo impiego si è ridotto da quando è stato scoperto l’impiego della mucosa buccale per 2 motivi: la mucosa buccale è più resistente ed evita la necessità della circoncisione.
Cute di altre regioni del corpo
In casi rari.
Tessuti eterologhi
Sono tessuti ricavati dagli animali o costruiti in laboratorio.
In alcuni casi sono stati utilizzati, ma è ancora da valutare nel tempo il risultato.
Colture cellulari
La coltivazione di tessuti in laboratorio e l’impiego delle cellule staminali è in fase sperimentale e ancora lontano dall’essere applicabile a questa chirurgia.
Complicanze post-operatorie
Bisogna correttamente avvisare i pazienti che la chirurgia dell’ipospadia fallita è caratterizzata da una elevata percentuale di complicanze (circa 30 %): questo è dovuto al fatto che i tessuti su cui opera il chirurgo sono spesso compromessi dai precedenti interventi.
Le complicanze più frequenti sono la stenosi uretrale, la fistola uretrale, la riapertura del meato ricostruito.
Queste complicanze possono richiedere un ulteriore intervento chirurgico di riparazione che però va effettuato ad almeno 6 mesi di distanza dal primo.
La probabilità di complicanze è ridotta da:
- meticolosa accuratezza chirurgica
- adeguato strumentario chirurgico
- giusta età del paziente
- esperienza del chirurgo che esegue di routine questa chirurgia.
Assistenza post-operatoria
Il paziente viene dimesso 1-2 giorni dopo l’intervento per ridurre la degenza ospedaliera ed il trauma psicologico.
Il periodo post-operatorio non è particolarmente doloroso.
Non sono necessarie medicazioni particolari.
Catetere
Sono utilizzati Cateteri piccoli e morbidi (in silicone) che drenano le urine dalla vescica all’esterno.
Il catetere viene mantenuto da un minimo di 1 ad un massimo di 15 giorni (a seconda dell’intervento chirurgico).
Medicazione del pene
La medicazione copre la ferita e immobilizza il pene per pochi giorni.
Nei primi giorni dopo l’intervento sono frequenti e
normali piccole perdite di sangue e perdite di urina in concomitanza delle spinte durante la defecazione.
Dopo la rimozione della medicazione si può osservare un lieve sanguinamento ed un aumento del gonfiore del pene.
I segni di un’infezione della ferita sono arrossamento cutaneo, pus e febbre: in questo caso è consigliabile rivolgersi al medico.
I punti di sutura sono riassorbibili e non vanno rimossi (questo riduce il dolore post-operatorio).
E’ consigliabile evitare la compressione della regione perineale e scrotale per 2 mesi: evitare la bicicletta. E’ consigliabile evitare l’attività sessuale per circa 1 mese.
Considerazioni
Oggi questa chirurgia è caratterizzata da una maggiore attenzione a ridurre il trauma psicologico tramite la scelta dell’intervento più adeguato e la riduzione dei tempi di ospedalizzazione (2-3 giorni). Inoltre, c’è una maggiore attenzione nel cercare di ottenere un buon risultato non solo funzionale ma anche estetico.
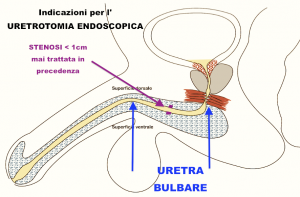
Uretrotomia endoscopica
Lo strumento endoscopico è introdotto dal pene. Alla sommità di questo strumento è montato un coltellino che taglia la cicatrice causa del restringimento del canale e consente di allargare l’uretra.
L’incisione ed allargamento dell’uretra tramite strumenti endoscopici non ha alcuna possibilità di curare un restringimento uretrale in pazienti con tessuti compromessi da ripetuti interventi chirurgici.
Negli ultimi anni le innovazioni tecnologiche hanno indotto a credere che il taglio della cicatrice tramite il laser (Uretrotomia laser ) potesse garantire dei risultati migliori. In realtà non abbiamo nessuna dimostrazione scientifica di questo e l’impiego del laser potrebbe causare dei danni importanti nei tessuti uretrali.
Dilatazioni uretrali
La manipolazione dell’uretra tramite ripetute dilatazioni è una manovra antica che oggi non ha più motivo di esistere. Queste manovre non hanno nessuna possibilità di curare il restringimento dell’uretra. Inoltre il ripetuto traumatismo determinato dalle dilatazioni può essere causa di infezioni urinarie e dell’estensione del danneggiamento dei tessuti uretrali.